Gabriela Feix Pereira ¹, ²; Bibiana Braga ¹; Gertrudes Corção 2
1 DORF KETAL BRASIL LTDA., P&D, Nova Santa Rita, RS – Brasil. 2 Universidade Federal do Rio Grande do Sul, Departamento de Microbiologia, Porto Alegre, RS – Brasil.
(1) Introducción
Durante la extracción y producción de petróleo, los procesos que involucran agua son propensos al crecimiento de microorganismos, y la proliferación descontrolada es un precursor de problemas graves, como la corrosión de estructuras metálicas, la formación de biopelículas y la generación de productos metabólicos, como el sulfuro de hidrógeno (H₂S), que además de los problemas de salud y seguridad, puede afectar la calidad del petróleo producido.
La principal fuente de agua durante los procesos de extracción y producción de petróleo es el agua producida. Esta agua se extrae del pozo junto con el petróleo crudo en forma de emulsión. En la plataforma, la emulsión se separa y el agua producida pasa por un proceso de tratamiento hasta cumplir con los requisitos para su descarga o reinyección en el pozo. El agua producida presenta una composición fisicoquímica compleja y variable, lo que genera una población microbiana diversa (Al-Ghouti et al., 2019).
Además de la composición variable del agua producida, las condiciones extremas del proceso de extracción/producción, como alta temperatura, bajo contenido de oxígeno y alta salinidad, seleccionan los microorganismos más adaptados. Los grupos de Bacterias Productoras de Ácido (BPA) y Bacterias Reductoras de Sulfato (BRS) están comúnmente presentes en el microbioma del agua producida (Li et al., 2017). Como producto del metabolismo fermentativo, en condiciones de ausencia o bajo contenido de oxígeno, las BPA pueden producir diversos tipos de ácidos orgánicos e inorgánicos, que reducen el pH del agua, afectando las reacciones electroquímicas y aumentando la tasa de corrosión del sistema. Las BRS, en presencia de sulfato u otras fuentes de azufre y en condiciones de ausencia o bajo contenido de oxígeno, generan H₂S a través del proceso de respiración celular. El H₂S es un gas tóxico, corrosivo e inflamable, motivo de gran preocupación en la industria petrolera.
Con base en esta información, el objetivo de este estudio fue evaluar las diferencias en la composición del microbioma de dos muestras de agua producida (AP 1 y AP 2), recolectadas en dos campos petroleros brasileños distantes. Se evaluó la acción de biocidas en la reducción de la concentración de BPA y BRS provenientes de estas muestras de agua producida. Se utilizaron los biocidas sulfato de tetrakis(hidroximetil) fosfonio (THPS) y glutaraldehído, ya que son ampliamente empleados en el tratamiento microbiológico del agua producida (Kahrilas et al., 2015; Korenblum et al., 2010).
(2) Materiales y Métodos
(2.1) Muestras de Agua Producida
Se utilizaron dos muestras de agua producida en este estudio. La muestra AP1 fue recolectada en un campo offshore ubicado en el sureste de Brasil. La muestra AP2 fue recolectada en un campo onshore ubicado en el noreste de Brasil. Las muestras se mantuvieron refrigeradas y se filtraron en filtros de 0,22 µm dentro de las 72 horas. Los filtros con los microorganismos retenidos se almacenaron a -20°C hasta el análisis.
(2.2) Análisis de la Composición Bacteriana de las Muestras de Agua Producida
(2.2.1) Extracción de ADN
El ADN genómico total se extrajo de las muestras por duplicado con el kit DNEasy PowerSoil (Qiagen, Alemania), siguiendo las instrucciones del fabricante. El ADN extraído de cada muestra se cuantificó con un fluorímetro Quantus (Promega, EE. UU.) utilizando el kit dsDNA BR Assay (Invitrogen, EE. UU.).
(2.2.2) Amplificación y Secuenciación del Gen 16S rRNA
La región V4 del gen 16S rRNA se amplificó con los cebadores 515F (5´ GTGCCAGCMGCCGCGGTAA 3´) y R806 (5´ GGACTACHVGGGTWTCTAAT 3’), ambos modificados para contener una región adaptadora Illumina (Caporaso et al., 2011). La amplificación del gen mediante PCR se realizó con una mezcla de aproximadamente 100 ng de ADN genómico, 1,0 mM de MgCl₂, 0,5 µM de cada cebador, 0,2 mM de cada dNTP, 2 U de Platinum Taq DNA Polymerase High Fidelity (Life Technologies, EE. UU.) y 1× tampón de reacción. Las condiciones de ciclaje térmico para la amplificación fueron una desnaturalización inicial (2 min a 94°C), seguida de 25 ciclos de desnaturalización (45 s a 94°C, 45 s a 55°C y 1 min a 72°C) y una extensión final (6 min a 72°C) en un termociclador Mastercycler Personal 5332 (Eppendorf, Alemania).
Los amplicones se purificaron con esferas Agencourt AMPure XP (Beckman Coulter, EE. UU.) siguiendo las instrucciones del fabricante. La secuenciación se realizó en la plataforma Illumina MiSeq (Illumina Inc., EE. UU.) con un kit v2 500, que genera secuencias de 250 pb. Los datos de secuenciación se procesaron con el software QIIME 2 (Hassan et al., 2018). Todos los análisis estadísticos se realizaron con scripts de Python implementados en QIIME 2. Después de agrupar las unidades taxonómicas operativas (OTU) con un 97% de similitud, el mapeo se realizó contra la base de datos RDP (Wang et al., 2007). La información de las secuencias metagenómicas está disponible en el European Bioinformatics Institute (EBI) en la base de datos EBI Metagenomics con el número de acceso ERP121357.
(2.3) Cultivo de BPA y BRS a partir de Muestras de Agua Producida
Los cultivos de BPA y BRS provenientes de las muestras de agua producida se enriquecieron durante 21 días a 35°C. Ambos cultivos se transfirieron semanalmente (10% de inóculo) a frascos que contenían medios de cultivo estériles. Para las BPA se utilizó el medio Caldo Rojo Fenol con glucosa (15 g·L⁻¹; Merck, Alemania). Para las BRS se utilizó el medio Postgate B modificado (McKenzie & Hamilton, 1992; Postgate, 1984). Antes de su uso, los medios de cultivo se purgaron con N₂ para reducir el contenido de oxígeno.
(2.4) Concentración Inhibitoria Mínima (CIM) de los Biocidas en los Cultivos de BPA y BRS
Para evaluar la resistencia de los cultivos de BPA y BRS a los biocidas glutaraldehído y THPS, se determinó la CIM de cada biocida. Se añadió un inóculo del 1% (v/v) y diferentes concentraciones de biocidas (50 a 1.000 mg·L⁻¹) a microplacas de 96 pocillos que contenían 200 µL de medio de cultivo (Schug et al., 2020). Para la validación de la prueba se utilizó un control positivo de cada cultivo sin biocida. El análisis se realizó por triplicado. Las microplacas se incubaron en una jarra de anaerobiosis que contenía un generador de anaerobiosis (Anaerobac, Probac, Brasil) durante 72 h a 35°C.
(3) Resultados y Discusión
(3.1) Composición Bacteriana de las Muestras de Agua Producida
La composición del microbioma en el agua producida, así como las características fisicoquímicas, es variable; sin embargo, algunos filos bacterianos son comunes en dichas muestras. En la mayoría de los casos, Proteobacteria es el filo predominante y está ampliamente distribuido en los ecosistemas petroleros, seguido por Firmicutes, Defferibacteres, Bacteroidetes, Actinobacteria y Thermotogae (Li et al., 2017). En este estudio, la Figura 1 muestra la abundancia relativa de los filos bacterianos encontrados en las muestras analizadas. El perfil de distribución de abundancia de los filos encontrados es similar al descrito en la literatura para otras muestras de agua producida analizadas. Esta tendencia puede explicarse por las condiciones extremas que se encuentran en los campos petroleros, como la presencia de hidrocarburos en el agua, la alta salinidad y las altas temperaturas. En general, este ambiente selecciona a los microorganismos más adaptados, pero las mayores diferencias se observan solo a nivel de orden y género.
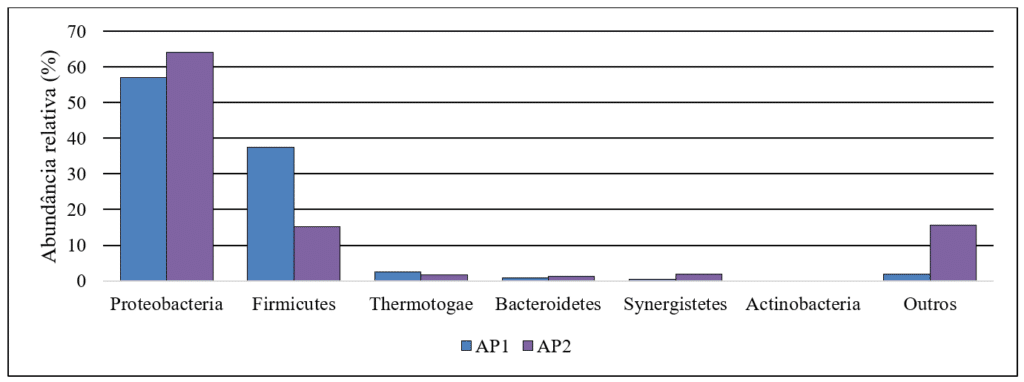
Figura 1 – Abundancia relativa de filos bacterianos en las muestras de agua producida.
A diferencia de los filos, la composición de géneros bacterianos varió significativamente entre las muestras de agua producida (Figuras 2A y 2B). Además, la diversidad de géneros en el microbioma de la muestra AP2 fue mayor que en la AP1. Otro aspecto destacable es la alta abundancia de géneros desconocidos en la muestra AP2 (45%). La mayor diversidad bacteriana y la predominancia de géneros bacterianos desconocidos en la muestra AP2 pueden ser factores que interfieran en la eficacia de los tratamientos con biocidas en campos petroleros terrestres.
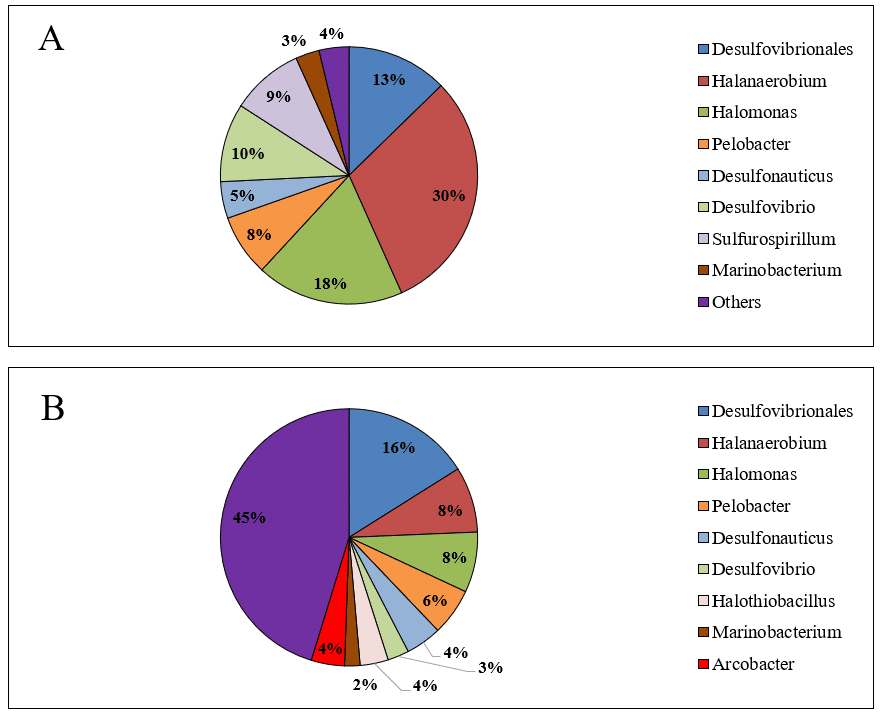
Figura 2 – Abundancia relativa de géneros bacterianos en las muestras de agua producida AP1 (A) y AP2 (B).
Las muestras analizadas en este estudio mostraron abundancia de géneros de BRS, comprendiendo el orden Desulfovibrionales, que se dividió entre el género Desulfovibrio y otros géneros no identificados, además del género Desulfonauticus. Aunque cada muestra presentó un perfil de abundancia diferente entre filos y géneros, la abundancia relativa total de BRS en las muestras correspondió al 28% en AP1 y 23% en AP2. Las BRS se desarrollan en presencia de sulfato, que utilizan como aceptor de electrones en la vía de reducción disimilatoria de sulfato para la generación de energía (Muyzer & Stams, 2008; Qian et al., 2019). Sin embargo, aunque se identificó la presencia de sulfato en las muestras (3.314 mg·L⁻¹ en AP1 y 692 mg·L⁻¹ en AP2), este no fue el único factor que moduló la composición de las BRS. Otros factores, como la temperatura, la salinidad y la competencia bacteriana, también influyen en la abundancia (Li et al., 2017).
Las muestras también mostraron abundancia significativa de BPA halofílicas y halotolerantes, como Halanaerobium y Halomonas, que se encuentran comúnmente en el agua producida debido a las condiciones de hipersalinidad. Halanaerobium, predominante en AP1 (30% de abundancia relativa; Figura 2A), es una bacteria anaerobia estricta y moderadamente halofílica que requiere concentraciones de NaCl entre 30.000 y 200.000 mg·L⁻¹ para su crecimiento (Oren, 2014). Las bacterias del género Halanaerobium son responsables de la reducción del tiosulfato y desempeñan un papel importante en la catálisis de la corrosión del acero al carbono, una metalurgia común en tanques, ductos y otras estructuras (Liang et al., 2014). La susceptibilidad de este género a los biocidas se evaluó en otro estudio, donde la bacteria Halanaerobium DL-01 fue expuesta a los biocidas THPS y glutaraldehído, mostrando la necesidad de utilizar altas concentraciones de glutaraldehído (500 mg·L⁻¹) y THPS (~406 mg·L⁻¹) para inhibir su crecimiento (Liang et al., 2016).
El género Pelobacter es otro género comúnmente encontrado en el agua producida (Vigneron et al., 2017). Este género consiste en bacterias gramnegativas estrictamente anaerobias, cuyos miembros son incapaces de fermentar azúcares y metabolizan solo un número muy limitado de sustratos. Las especies de Pelobacter desempeñan papeles importantes en la degradación fermentativa de sustratos poco comunes, como etanol y butanol, pudiendo utilizar azufre (S°) como aceptor de electrones en estas reacciones (Sun et al., 2010). Además, estudios indican la asociación de especies de Pelobacter con bacterias metanogénicas en la degradación de alcanos de petróleo crudo (Gray et al., 2011).
Las bacterias no identificadas denominadas “otras” se cuantificaron en diferentes proporciones en ambas muestras. AP1 presentó solo 4% de bacterias no identificadas, mientras que AP2 presentó 45%. El metagenoma complejo y las condiciones extremas y únicas encontradas en los campos petroleros pueden ser las razones del alto número de bacterias aún no identificadas.
(3.2) Resistencia de los Cultivos de BRS y BPA a los Biocidas
Los cultivos de BPA y BRS se utilizaron para determinar la CIM del glutaraldehído y del THPS. La Tabla 1 presenta los resultados obtenidos tras la evaluación. Las respuestas de los cultivos de BRS a los biocidas variaron, siendo el glutaraldehído el que presentó una menor CIM en AP1 y el THPS en AP2. En el caso de las BPA, se observó la necesidad de altas concentraciones de ambos biocidas (superiores a 1.000 mg·L⁻¹) para inhibir el crecimiento, lo que demuestra un alto nivel de resistencia a estas moléculas cuando se utilizan individualmente.
Tabla 1 – CIM del glutaraldehído y THPS en cultivos de BRS y BPA provenientes de muestras de agua producida.
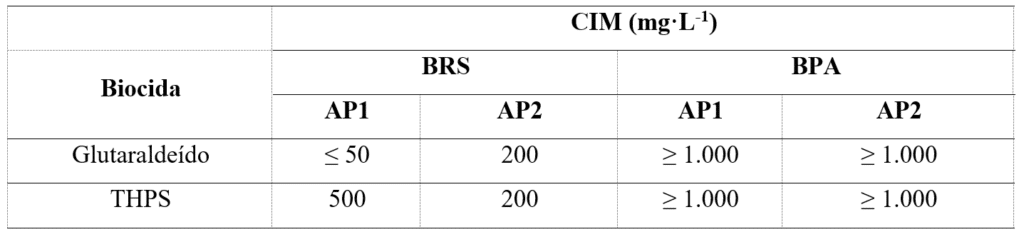
Los diferentes niveles de resistencia en cultivos bacterianos del mismo grupo, pero de diferentes orígenes, demuestran la importancia del análisis caso por caso para definir el tratamiento microbiológico más adecuado.
(4) Consideraciones Finales
Los estudios sobre la composición bacteriana en los campos petroleros y sus impactos en diferentes áreas se han desarrollado a lo largo de los años; sin embargo, las interacciones entre la población bacteriana y la resistencia a biocidas deben comprenderse mejor. En este estudio, aunque presentaron abundancias distintas entre las muestras, los grupos BRS y BPA fueron predominantes. Como ambos grupos son conocidos por su participación en la corrosión de estructuras metálicas, la formación de biopelículas y la generación de H₂S (Li et al., 2017), y son los principales objetivos de los biocidas, se concluye que las dos muestras analizadas presentaban un alto potencial de daño en plataformas.
Las respuestas de los cultivos de BRS y BPA a los biocidas variaron, destacando así la necesidad de definir tratamientos personalizados, teniendo en cuenta el nivel de resistencia de la población existente en el lugar de aplicación frente a los biocidas. Además, pueden utilizarse otras estrategias para aumentar la eficiencia de los tratamientos microbiológicos, como la aplicación de más de un biocida con diferentes modos de acción, lo que amplía el espectro de acción y reduce la resistencia bacteriana, así como el monitoreo del tratamiento para ajustar la dosificación y acompañar la eficiencia.
(5) Referencias
Al-Ghouti, M. A., Al-Kaabi, M. A., Ashfaq, M. Y., & Da’na, D. A. (2019). Produced water characteristics, treatment and reuse: A review. In Journal of Water Process Engineering. https://doi.org/10.1016/j.jwpe.2019.02.001
Caporaso, J. G., Lauber, C. L., Walters, W. A., Berg-Lyons, D., Lozupone, C. A., Turnbaugh, P. J., Fierer, N., & Knight, R. (2011). Global patterns of 16S rRNA diversity at a depth of millions of sequences per sample. Proceedings of the National Academy of Sciences, 108(Supplement 1), 4516–4522. https://doi.org/10.1073/pnas.1000080107
Gray, N. D., Sherry, A., Grant, R. J., Rowan, A. K., Hubert, C. R. J., Callbeck, C. M., Aitken, C. M., Jones, D. M., Adams, J. J., Larter, S. R., & Head, I. M. (2011). The quantitative significance of Syntrophaceae and syntrophic partnerships in methanogenic degradation of crude oil alkanes. Environmental Microbiology. https://doi.org/10.1111/j.1462-2920.2011.02570.x
Hassan, M., Essam, T., & Megahed, S. (2018). Illumina sequencing and assessment of new cost-efficient protocol for metagenomic-DNA extraction from environmental water samples. Brazilian Journal of Microbiology. https://doi.org/10.1016/j.bjm.2018.03.002
Kahrilas, G. A., Blotevogel, J., Stewart, P. S., & Borch, T. (2015). Biocides in Hydraulic Fracturing Fluids: A Critical Review of Their Usage, Mobility, Degradation, and Toxicity. Environmental Science & Technology, 49(1), 16–32. https://doi.org/10.1021/es503724k
Korenblum, E., Valoni, É., Penna, M., & Seldin, L. (2010). Bacterial diversity in water injection systems of Brazilian offshore oil platforms. Applied Microbiology and Biotechnology, 85(3), 791–800. https://doi.org/10.1007/s00253-009-2281-4
Li, X. X., Mbadinga, S. M., Liu, J. F., Zhou, L., Yang, S. Z., Gu, J. D., & Mu, B. Z. (2017). Microbiota and their affiliation with physiochemical characteristics of different subsurface petroleum reservoirs. In International Biodeterioration and Biodegradation. https://doi.org/10.1016/j.ibiod.2017.02.005
Liang, R., Davidova, I. A., Marks, C. R., Stamps, B. W., Harriman, B. H., Stevenson, B. S., Duncan, K. E., & Suflita, J. M. (2016). Metabolic Capability of a Predominant Halanaerobium sp. in Hydraulically Fractured Gas Wells and Its Implication in Pipeline Corrosion. Frontiers in Microbiology, 7, 988. https://doi.org/10.3389/fmicb.2016.00988
Liang, R., Grizzle, R., Duncan, K., McInerney, M., & Suflita, J. (2014). Roles of thermophilic thiosulfate-reducing bacteria and methanogenic archaea in the biocorrosion of oil pipelines. Frontiers in Microbiology, 5, 89. https://doi.org/10.3389/fmicb.2014.00089
McKenzie, J., & Hamilton, W. A. (1992). The assay of in-situ activities of sulphate-reducing bacteria in a laboratory marine corrosion model. International Biodeterioration & Biodegradation, 29(3–4), 285–297.
Muyzer, G., & Stams, A. J. M. (2008). The ecology and biotechnology of sulphate-reducing bacteria. In Nature Reviews Microbiology. https://doi.org/10.1038/nrmicro1892
Oren, A. (2014). The Order Halanaerobiales, and the Families Halanaerobiaceae and Halobacteroidaceae. In E. Rosenberg, E. F. DeLong, S. Lory, E. Stackebrandt, & F. Thompson (Eds.), The Prokaryotes: Firmicutes and Tenericutes (pp. 153–177). Springer Berlin Heidelberg. https://doi.org/10.1007/978-3-642-30120-9_218
Postgate, J. R. (1984). The Sulphate-Reducing Bacteria (2nd ed.). Cambridge University Press.
Qian, Z., Tianwei, H., Mackey, H. R., van Loosdrecht, M. C. M., & Guanghao, C. (2019). Recent advances in dissimilatory sulfate reduction: From metabolic study to application. In Water Research. https://doi.org/10.1016/j.watres.2018.11.018
Schug, A. R., Bartel, A., Scholtzek, A. D., Meurer, M., Brombach, J., Hensel, V., Fanning, S., Schwarz, S., & Feßler, A. T. (2020). Biocide susceptibility testing of bacteria: Development of a broth microdilution method. Veterinary Microbiology, 248, 108791. https://doi.org/https://doi.org/10.1016/j.vetmic.2020.108791
Sun, J., Haveman, S. A., Bui, O., Fahland, T. R., & Lovley, D. R. (2010). Constraint-based modeling analysis of the metabolism of two Pelobacter species. BMC Systems Biology. https://doi.org/10.1186/1752-0509-4-174
Vigneron, A., Alsop, E. B., Lomans, B. P., Kyrpides, N. C., Head, I. M., & Tsesmetzis, N. (2017). Succession in the petroleum reservoir microbiome through an oil field production lifecycle. ISME Journal. https://doi.org/10.1038/ismej.2017.78
Wang, Q., Garrity, G. M., Tiedje, J. M., & Cole, J. R. (2007). Naïve Bayesian classifier for rapid assignment of rRNA sequences into the new bacterial taxonomy. Applied and Environmental Microbiology. https://doi.org/10.1128/AEM.00062-07