Gabriela Feix Pereira* 1, 2, Taiah Rajeh Rosin 2, Bibiana Braga ², Gertrudes Corção1
1 ICBS, Departamento de Microbiología, UFRGS, Porto Alegre – RS ² Dorf Ketal, Centro de Investigación, Desarrollo e Innovación, Nova Santa Rita – RS
Resumen
El control microbiano en campos petroleros puede considerarse un tema complejo, ya que la diversidad del microbioma y las características fisicoquímicas del agua producida (AP) originan un perfil único. Los biocidas se utilizan como tratamiento microbiológico, pero la toxicidad relacionada con los grandes volúmenes utilizados puede causar problemas ambientales. La eficiencia de los biocidas y, en consecuencia, la reducción del impacto ambiental, pueden mejorarse mediante una planificación adecuada. Con base en información de la literatura relacionada con biocidas, los microorganismos presentes en AP y sus mecanismos de resistencia, este artículo sugiere un enfoque de cinco etapas para tratamientos microbiológicos: 1) determinación de objetivos; 2) bioauditoría; 3) selección en laboratorio del/los biocida(s); 4) selección de indicadores clave de desempeño (KPI) viables y representativos; y 5) monitoreo del tratamiento. Finalmente, este artículo presenta resultados de un estudio de caso orientado a la optimización de un tratamiento microbiológico aplicando el enfoque de cinco etapas. Los resultados mostraron una reducción de aproximadamente el 50% en la dosificación del biocida y protección del sistema por 14 días, en comparación con 2 días de protección del tratamiento anterior.
Introducción
El agua producida (AP) es el principal residuo acuoso generado en campos petroleros, y el aumento de la producción de petróleo a lo largo de los años ha llevado a la generación de volúmenes aún mayores (AL-GHOUTI et al., 2019). El volumen de AP generado está directamente relacionado con la edad del yacimiento y el método de extracción utilizado. En pozos maduros, el volumen de AP puede llegar a ser nueve veces el volumen de petróleo extraído. Además, durante el proceso de recuperación secundaria mediante inyección de agua de mar, el volumen generado de AP tiende a ser aún mayor (JIMÉNEZ et al., 2018).
La gestión del AP es un punto crítico, ya que su composición fisicoquímica variable y las condiciones de procesamiento y almacenamiento impulsan el desarrollo de microorganismos. Los procariotas reductores de sulfato (PRS) y las bacterias productoras de ácido (BPA) son ubicuas en este entorno y están asociadas a diversos problemas, como deficiencias en la integridad de las instalaciones y cuestiones de salud y seguridad de los trabajadores. El grupo PRS es conocido principalmente por la producción de sulfuro de hidrógeno (H2S), un gas corrosivo y tóxico (MUYZER; STAMS, 2008). Además, la liberación de metabolitos altamente corrosivos por BPA también contribuye al aumento de la biocorrosión (MARCIALES et al., 2019). Además de los papeles individuales de PRS y BPA, ya se han informado interacciones sintrofias entre ambos grupos (XU; LI; GU, 2016; DAWUDA; TALEB-BERROUANE; KHAN, 2021).
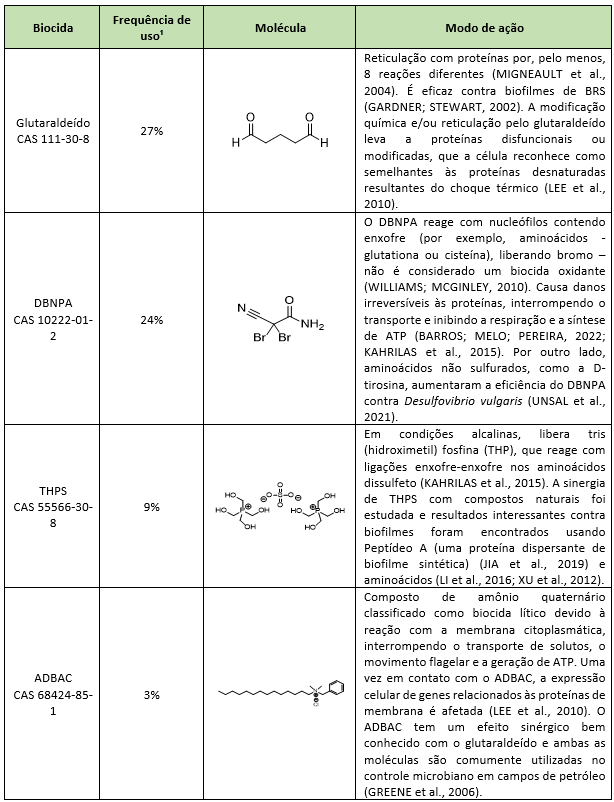
Se sugiere firmemente el uso de biocidas como herramienta de mitigación y prevención de problemas microbiológicos. Los biocidas más utilizados a nivel mundial en la industria petrolera son glutaraldehído, 2,2-dibromo-3-nitrilopropionamida (DBNPA), sulfato de tetraquis(hidroximetil)fosfonio (THPS) y cloruro de bencil dimetil amonio (ADBAC) (KAHRILAS et al., 2015). Sin embargo, tratamientos microbiológicos mal planificados pueden desencadenar resistencia microbiana, disminuyendo considerablemente la eficacia del tratamiento y aumentando los daños ambientales debido al aumento de la dosificación del biocida impulsado por la pérdida de eficiencia.
Para la planificación adecuada del tratamiento microbiológico deben considerarse las variables fisicoquímicas y microbiológicas del sistema. En este artículo, el impacto de estas variables en el tratamiento se reduce mediante la aplicación de cinco etapas durante la planificación: 1) objetivos bien definidos; 2) bioauditoría para una visión integrada del sistema; 3) selección de biocida(s) adecuados en laboratorio, considerando las condiciones del proceso y la susceptibilidad de los objetivos microbianos; 4) selección de KPI viables y representativos; y 5) monitoreo del tratamiento. Por último, este artículo demuestra un estudio de caso utilizando este enfoque de cinco etapas.
Composición microbiológica del AP
La geología de los yacimientos y los procesos de separación del petróleo determinan las características fisicoquímicas del AP, y estas características seleccionan los microorganismos mejor adaptados. En general, debido a las condiciones extremas, el microbioma de los campos petroleros está compuesto predominantemente por bacterias, aunque la presencia de arqueas también se informa con frecuencia (SIERRA-GARCIA et al., 2017; HIDALGO et al., 2021).
Debido al impacto negativo en la cadena del petróleo, algunos grupos microbianos son más estudiados que otros. Los PRS, principalmente las bacterias reductoras de sulfato (BRS), el grupo más estudiado, están directamente relacionados con la generación biológica de sulfuro de hidrógeno (H2S) y se han asociado con la biocorrosión tipo I (JIA et al., 2019a; RAJBONGSHI; GOGOI, 2021). El grupo de las BPA, también denominadas bacterias fermentativas, liberan subproductos metabólicos corrosivos que pueden aumentar la biocorrosión tipo II (JIA et al., 2019a; MARCIALES et al., 2019). Además del papel individual de BRS y BPA, se han informado interacciones sintrofias, en las que las BRS utilizan subproductos metabólicos de las BPA (por ejemplo, lactato y acetato) como fuente de carbono. En definitiva, estas interacciones sintrofias confieren robustez a la estructura de los biofilms. Además de la relación sintrofia, otra variable durante la formación de biofilms es la tolerancia al oxígeno. Las BRS, anaerobias estrictas, se depositan en la base del biofilm y, debido a las relaciones sintrofias entre los grupos, las BPA se depositan en capas superiores, ya que son más tolerantes al oxígeno. Estas estructuras heterogéneas generan focos de biocorrosión dinámicos, que mezclan mecanismos tanto del tipo I (por acción de las BRS) como del tipo II (por acción de las BPA), dificultando su control. Además, los biofilms gruesos y heterogéneos dificultan la penetración del biocida, requiriendo en promedio una concentración de biocida diez veces mayor para la mitigación, en comparación con las bacterias planctónicas (de vida libre) (XU; LI; GU, 2016).
Aunque menos reportados, otros grupos microbianos desempeñan un papel en los procesos de biocorrosión y deterioro del petróleo, como las arqueas metanogénicas y las bacterias reductoras de nitrato (BRN) (LAHME et al., 2019; JI et al., 2020). Las arqueas metanogénicas desempeñan un papel importante en la biodegradación de hidrocarburos debido a su capacidad para oxidar el hidrógeno del petróleo crudo y otros componentes como n-alcanos, benceno, tolueno e hidrocarburos aromáticos policíclicos (RAJBONGSHI; GOGOI, 2021). Las BRN reducen el nitrato a nitrito y pueden eliminar el sulfuro existente o inhibir la producción de sulfuro en el AP por BRS (RAJBONGSHI; GOGOI, 2021).
Resistencia bacteriana a biocidas
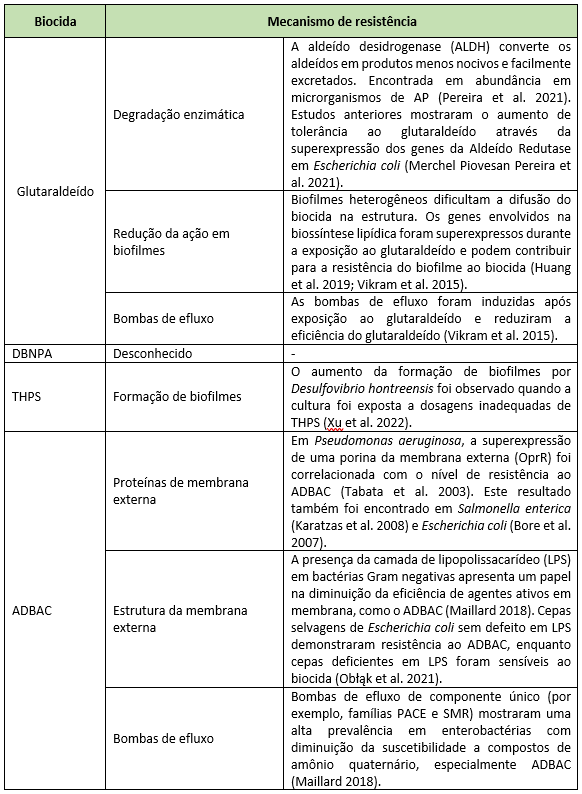
La forma más común de mitigar problemas microbianos en campos petroleros es la aplicación de biocidas. Los biocidas estándar utilizados en todo el mundo en AP, sus modos de acción y frecuencia de uso, se describen en la Tabla 1. Los mecanismos de resistencia bacteriana descritos para esos biocidas estándar se muestran en la Tabla 2. Los biocidas utilizados casi exclusivamente en campos petroleros (es decir, THPS y DBNPA) no han tenido su modo de acción y mecanismos de resistencia completamente dilucidados debido a la falta de bibliografía disponible. Por otro lado, los biocidas comúnmente aplicados en las áreas de salud y alimentos presentan una alta densidad de información.
Entre los principales mecanismos de resistencia descritos para biocidas se encuentran las bombas de eflujo y la formación de biofilms. Las bombas de eflujo son responsables de reducir la concentración de moléculas tóxicas en el interior de la célula bacteriana. Las familias de bombas de eflujo AcrAB–TolC y MATE están ampliamente diseminadas entre especies bacterianas y pueden conferir menor susceptibilidad a una amplia variedad de biocidas, como compuestos de amonio cuaternario y glutaraldehído. El aumento en la expresión de genes relacionados con bombas de eflujo se ha identificado durante la exposición a biocidas, respaldando el papel de este importante mecanismo de resistencia en bacterias (MORENTE et al., 2013; BEDOYA et al., 2021). Además de las bombas de eflujo, la formación de biofilms también es un mecanismo importante de resistencia, especialmente en los campos petroleros. Estos son ambientes altamente estresantes, con nutrientes limitados y pH y temperaturas extremos. Estas condiciones, junto con la presencia de biocidas, pueden desencadenar respuestas morfológicas en la población bacteriana que se adhieren inmediatamente a una superficie como estrategia de supervivencia. Después de la fase de adhesión del biofilm, la fase de crecimiento puede ocurrir en tuberías con bajos caudales o tanques de almacenamiento, donde tanto el agua como los sólidos en suspensión se depositan en el fondo, creando condiciones en las que bacterias sésiles están expuestas a ciclos intermitentes de presencia y agotamiento de nutrientes, resultando en biofilms gruesos (JENNEMAN; DE LEÓN, 2022).
Tratamiento del AP con biocidas
El uso de biocidas para controlar el crecimiento bacteriano en campos petroleros no ha sido seriamente considerado. Un tratamiento biocida inadecuado puede contribuir al aumento de la presión selectiva y, en consecuencia, de la resistencia bacteriana (CAMPA et al., 2019). Con ello, el escenario ideal sería el establecimiento de tratamientos más específicos y mejor planificados.
Un caso de implementación de tratamiento biocida considerando condiciones fisicoquímicas y microbiológicas fue descrito anteriormente. Muestras de cuatro campos petroleros diferentes (dos brasileños y dos argentinos) que presentaban problemas de resistencia al tratamiento actual (THPS en dosificación continua) fueron evaluadas en laboratorio utilizando técnicas moleculares y dependientes de cultivo. Las evaluaciones de laboratorio demostraron la combinación más eficiente de biocidas y el beneficio del cambio en el esquema de aplicación, indicando aplicación en lotes en lugar de aplicación continua. El monitoreo se realizó mediante la concentración de bacterias anaerobias totales y, como resultado, después del primer mes, los cuatro campos petroleros lograron una reducción de 6 log en la concentración bacteriana (PASCHOALINO et al., 2019). Los resultados descritos en este estudio proporcionan base para el enfoque de cinco etapas descrito en detalle en este tópico.
Etapa 1 – Objetivos del tratamiento
Diversas razones pueden explicar la aplicación de biocidas en AP, por ejemplo, el control de la biocorrosión, la reducción de H2S, la limpieza de tanques y tuberías, la inhibición o erradicación de biofilms en filtros. Así, antes de iniciar el tratamiento, es importante enumerar los problemas que pueden resolverse con la aplicación del biocida y los principales objetivos microbianos, a fin de delinear los objetivos del tratamiento. A pesar del amplio espectro de acción de los biocidas en general, la susceptibilidad de los microorganismos es variable (PEREIRA; PILZ-JUNIOR; CORÇÃO, 2021) y la aplicación del biocida difícilmente alcanzará con la misma magnitud a todos los grupos presentes en el AP; por lo tanto, se destaca la importancia de definir el objetivo principal del tratamiento y los objetivos microbianos.
Etapa 2 – Bioauditoría
La etapa de bioauditoría busca investigar la presencia de microorganismos a lo largo del proceso y encontrar los puntos críticos de contaminación. Durante la evaluación, se identifican los puntos del proceso con mayores concentraciones y se consideran candidatos para la inyección del biocida.
La bioauditoría consiste en el barrido del proceso mediante el uso de herramientas microbiológicas con enfoques moleculares, enzimáticos o dependientes de cultivo (PASCHOALINO, 2021). Los análisis basados en técnicas dependientes de cultivo son los más utilizados y recomendados por las normas del área para determinar la concentración bacteriana. La norma NACE TM0194-2014 – Field Monitoring of Bacterial Growth in Oil and Gas Systems, por ejemplo, describe el método y el medio de cultivo para la enumeración de BRS y otros grupos bacterianos. La norma API-RP-38 – Recommended Practice for Biological Analysis of Subsurface Injection Waters también recomienda diferentes medios de cultivo para la enumeración bacteriana.
En la práctica, puede ser necesaria la complementación de estos análisis con métodos moleculares, independientes de cultivo, pues se sabe que al menos el 90% de los microorganismos encontrados en campos petroleros no son cultivables (SKOVHUS; WHITBY, 2019). Un estudio evaluó mediante la técnica de 16S rRNA la composición microbiana de una muestra de agua de inyección y del consorcio bacteriano crecido en medio de cultivo originado de esta muestra. Los resultados mostraron que la dinámica de la población microbiana cambió en ambos casos, afectando las respuestas a los biocidas (ROMERO et al., 2005).
A pesar de las desventajas en términos de costo, el uso de métodos moleculares puede ser crucial en la definición de los objetivos del tratamiento biocida. Diversos estudios informan el uso de la secuenciación del gen 16S rRNA para evaluar la diversidad del microbioma en campos petroleros (KEASLER et al., 2013; LI et al., 2017; HIDALGO et al., 2021). Otra herramienta molecular importante en esta área de estudio es la técnica de PCR en tiempo real (RTPCR), que utiliza cebadores para cuantificar genes específicos y correlacionarlos con los microorganismos presentes en la muestra. Con esta misma herramienta también puede evaluarse la expresión de genes de resistencia, que pueden afectar la eficacia del tratamiento microbiológico (CAMPA et al., 2019).
También pueden utilizarse herramientas enzimáticas en la etapa de bioauditoría. La cuantificación de ATP proporciona datos sobre la concentración total de células viables en la muestra (HAMMES et al., 2010). Aunque no se recomienda como herramienta única debido al amplio alcance de la respuesta—considerando no solo microorganismos, sino cualquier célula viable presente en la muestra—puede utilizarse como técnica complementaria.
Etapa 3 – Selección de biocidas en laboratorio
Además de la composición microbiológica, también deben considerarse los datos fisicoquímicos de los puntos candidatos a inyección antes del cribado de biocidas, ya que la estabilidad química de los biocidas sintéticos puede verse perjudicada por condiciones como pH, temperatura y presencia de químicos reactivos (Williams y Schultz 2015). La Tabla 3 muestra los principales interferentes conocidos en la estabilidad química de los biocidas. Considerando la estabilidad química, esta etapa busca encontrar los biocidas más eficientes en las condiciones del sistema.
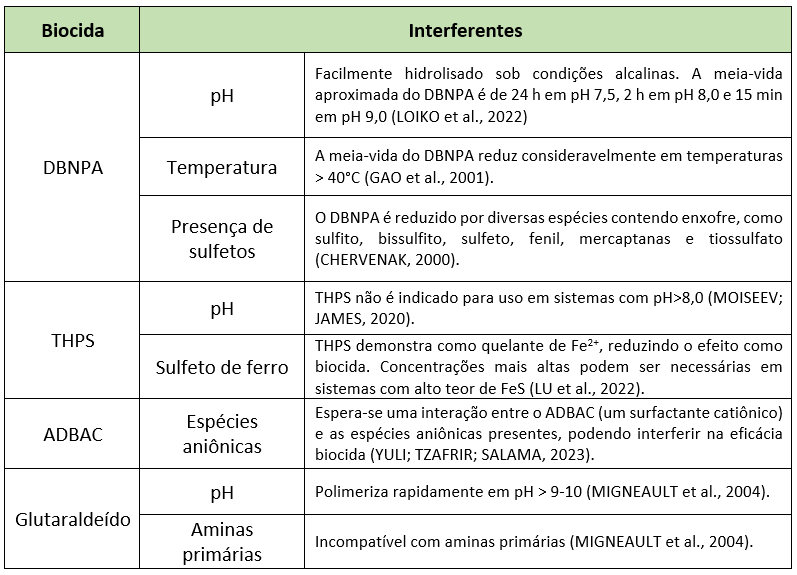
Los métodos estándar mencionados en la etapa 2 (ítem 3.2.) también pueden utilizarse en la etapa de cribado para determinar la susceptibilidad de bacterias planctónicas a biocidas. Para la evaluación de la eficiencia de biocidas en biofilms, la norma NACE TM21495 – Laboratory Evaluation of the Effect of Biocides on Biofilms aborda protocolos de evaluación de laboratorio basados en medio de cultivo (WADE et al., 2023). Además, los biofilms pueden evaluarse mediante crecimiento en microplacas de 96 pocillos y lectura por espectrofotometría (STEPANOVIĆ et al., 2007), o sobre cupones metálicos con cuantificación por Número Más Probable (NMP) (JIA et al., 2017; WANG y otros, 2022).
Etapa 4 – Selección de Indicadores Clave de Desempeño (KPI)
Los KPI se utilizan para cuantificar la efectividad del tratamiento microbiológico (JOHNSON, 2017; KEASLER et al., 2017), y su uso adecuado es una de las claves para un tratamiento eficaz (JIANG et al., 2021). La selección de KPI depende de los objetivos definidos para el tratamiento (etapa 1; ítem 3.1.), de los objetivos microbianos (etapa 2; ítem 3.2.) y de los biocidas seleccionados (etapa 3; ítem 3.3.). Este estudio clasificó los KPI en enfoques directos e indirectos. Los KPI directos se refieren directamente a datos relacionados con el crecimiento microbiano y los biocidas. Ejemplos de KPI directos son la concentración de células planctónicas o sésiles en los sistemas y el contenido residual de biocida. Los KPI indirectos están relacionados con la integridad del sistema y datos fisicoquímicos, por ejemplo, tasas de corrosión, contenido de H2S, presión en tuberías y filtros de agua.
Etapa 5 – Monitoreo del tratamiento
Es indispensable que las herramientas seleccionadas para el monitoreo de KPI sean herramientas viables para su uso en campos petroleros, considerando la infraestructura disponible. El monitoreo de los KPI seleccionados apoya la toma de decisiones relacionada con el tratamiento (JOHNSON, 2017). Los métodos para el monitoreo de KPI directos pueden abarcar desde técnicas dependientes de cultivo hasta técnicas moleculares (PASCHOALINO, 2021); se describieron ejemplos en la etapa 2 (ítem 3.2.). En cuanto a los KPI indirectos, el contenido de H2S puede monitorearse mediante métodos de titulación (NASSER et al., 2021), y las tasas de corrosión pueden monitorearse mediante cupones metálicos instalados a lo largo del sistema, sondas de resistencia eléctrica, instrumentos de polarización lineal o métodos equivalentes (AL-JANABI, 2020). Además, datos de seguimiento del proceso, como presión, caudal y otros, pueden utilizarse como KPI.
Estudio de caso
Además de la optimización del tratamiento microbiológico descrita por Paschoalino et al. 2019 en campos terrestres, se realizó la optimización de un tratamiento biocida en una plataforma offshore brasileña por Dorf Ketal Brasil Ltda. La plataforma estaba ubicada en la capa del Presal de la Cuenca de Santos, en una lámina de agua de aproximadamente 2.240 m.
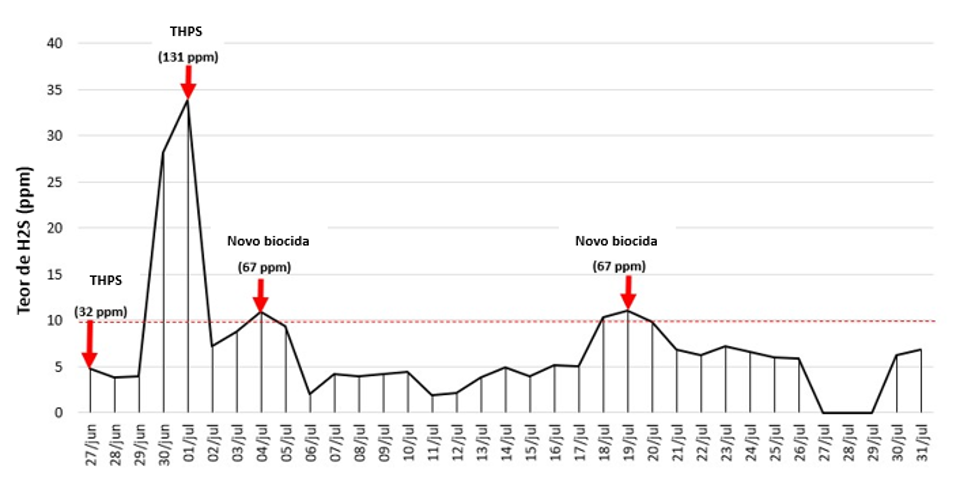
Antes de la optimización, el biocida THPS se aplicaba en el slop tank dos veces por semana a una concentración de aproximadamente 130 ppm por lote. El tanque presentaba una gruesa capa de petróleo en la superficie, lo que dificultaba el paso del THPS al agua. Además, debido a la rápida degradación de la molécula, no se observó eficiencia a largo plazo, resultando en la necesidad de aumentar la frecuencia de aplicación.
El objetivo principal de aplicar un tratamiento microbiológico en el slop tank era controlar la generación de H2S, y el objetivo de la optimización del tratamiento era reducir la frecuencia de aplicación del biocida. Como objetivo microbiano, se establecieron las BRS debido a su papel en la generación de H2S. Se enviaron muestras de agua del tanque al laboratorio de Dorf Ketal y, con base en el historial de resistencia al THPS, en el objetivo microbiano y en las condiciones fisicoquímicas del agua, se desarrolló un biocida personalizado.
Tras el desarrollo en laboratorio, se realizó una prueba de campo para definir la concentración del biocida y la frecuencia de aplicación en el slop tank (Fig. 1). La concentración de H2S en el agua se utilizó como un KPI indirecto para el monitoreo, y el límite aceptable de concentración de H2S era de 10 ppm. Además del monitoreo por contenido de H2S, la concentración de ATP se utilizó como un KPI directo.
Como resultado, la optimización resultó en un control de H2S de 14 días con la mitad de la concentración (67 ppm) en comparación con el THPS utilizado anteriormente (131 ppm). La eficiencia en el control microbiano, cuantificada por la concentración de ATP, alcanzó el 89% con el tratamiento optimizado (datos no mostrados).
Conclusiones
Con foco en la optimización del control microbiano y en la reducción de la interferencia de variables fisicoquímicas y microbiológicas, este artículo sugiere un enfoque en cinco etapas para tratamientos microbiológicos. Los objetivos del tratamiento deben estar claros antes de la planificación, y es deseable una bioauditoría para comprender la composición del microbioma y seleccionar objetivos microbianos precisos. Tras seleccionar los objetivos microbianos, una selección de biocidas en laboratorio puede demostrar qué biocidas son adecuados considerando su eficiencia y estabilidad química. Finalmente, KPI representativos de acuerdo con los objetivos del tratamiento pueden monitorearse mediante diversas técnicas descritas en este artículo. En un estudio de caso, el uso del enfoque de cinco etapas resultó en la reducción de la frecuencia de aplicación de un biocida en el slop tank de una plataforma ubicada en el Presal brasileño. La optimización resultó en un control de H2S de 14 días utilizando el tratamiento personalizado, mediante la aplicación de una dosificación un 50% menor en comparación con el biocida utilizado anteriormente (THPS).
Referencias
BBAS, R. H.; HERNANDEZ, J. F.; AL ABBAS, F. M. Holding Water — A Corrosion Management Program in a Vast Seawater Injection SystemCORROSION 2020, 14 jun. 2020. .
AL-GHOUTI, M. A. et al. Produced water characteristics, treatment and reuse: A reviewJournal of Water Process Engineering, 2019. .
AL-JANABI, Y. T. An overview of corrosion in oil and gas industry: upstream, midstream, and downstream sectors. Corrosion Inhibitors in the Oil and Gas Industry, p. 1–39, 2020.
BARROS, A. C.; MELO, L. F.; PEREIRA, A. A Multi-Purpose Approach to the Mechanisms of Action of Two Biocides (Benzalkonium Chloride and Dibromonitrilopropionamide): Discussion of Pseudomonas fluorescens’ Viability and Death. Frontiers in Microbiology, v. 13, p. 842414, 2022.
BEDOYA, K. et al. Assessment of the microbial community and biocide resistance profile in production and injection waters from an Andean oil reservoir in Colombia. International Biodeterioration & Biodegradation, v. 157, p. 105137, 2021. Disponível em: <https://www.sciencedirect.com/science/article/pii/S0964830520310684>.
BORE, E. et al. Adapted tolerance to benzalkonium chloride in Escherichia coli K-12 studied by transcriptome and proteome analyses. Microbiology, v. 153, n. 4, p. 935–946, 2007.
CAMPA, M. F. et al. Unconventional oil and gas energy systems: an unidentified hotspot of antimicrobial resistance? Frontiers in microbiology, v. 10, p. 2392, 2019.
CHERVENAK, M. C. The environmental fate of commonly used oxidizing and non-oxidizing biocides: reactions of industrial water biocides within the system. In: Int Environ Conf Exhibit, Anais…Citeseer, 2000.
DAWUDA, A.-W.; TALEB-BERROUANE, M.; KHAN, F. A probabilistic model to estimate microbiologically influenced corrosion rate. Process Safety and Environmental Protection, v. 148, p. 908–926, 2021.
EL-AZIZI, M.; FARAG, N.; KHARDORI, N. Efficacy of selected biocides in the decontamination of common nosocomial bacterial pathogens in biofilm and planktonic forms. Comparative immunology, microbiology and infectious diseases, v. 47, p. 60–71, 2016.
GAO, Y. et al. Efficacy of DBNPA against Legionella pneumophila: experimental results in a model water system. ASHRAE Transactions, v. 107, p. 184, 2001.
GARDNER, L. R.; STEWART, P. S. Action of glutaraldehyde and nitrite against sulfate-reducing bacterial biofilms. Journal of Industrial Microbiology and Biotechnology, v. 29, n. 6, p. 354–360, 1 dez. 2002. Disponível em: <https://doi.org/10.1038/sj.jim.7000284>.
GREENE, E. A. et al. Synergistic inhibition of microbial sulfide production by combinations of the metabolic inhibitor nitrite and biocides. Applied and Environmental Microbiology, 2006.
HIDALGO, K. J. et al. Genome-Resolved Meta-Analysis of the Microbiome in Oil Reservoirs WorldwideMicroorganisms , 2021. .
HUANG, L. et al. Role of LptD in Resistance to Glutaraldehyde and Pathogenicity in Riemerella anatipestifer Frontiers in Microbiology , 2019. . Disponível em: <https://www.frontiersin.org/article/10.3389/fmicb.2019.01443>.
JENNEMAN, G. E.; DE LEΌN, K. B. Environmental stressors alter the susceptibility of microorganisms to biocides in upstream oil and gas systems. International Biodeterioration & Biodegradation, v. 169, p. 105385, 2022.
JI, J.-H. et al. Methanogenic biodegradation of C13 and C14 n-alkanes activated by addition to fumarate. International Biodeterioration & Biodegradation, v. 153, p. 104994, 2020.
JIA, R. et al. Laboratory testing of enhanced biocide mitigation of an oilfield biofilm and its microbiologically influenced corrosion of carbon steel in the presence of oilfield chemicals. International Biodeterioration & Biodegradation, v. 125, p. 116–124, 2017. Disponível em: <https://www.sciencedirect.com/science/article/pii/S0964830517308508>.
JIA, R. et al. Microbiologically influenced corrosion and current mitigation strategies: A state of the art reviewInternational Biodeterioration and Biodegradation, 2019a. .
JIA, R. et al. A sea anemone-inspired small synthetic peptide at sub-ppm concentrations enhanced biofilm mitigation. International Biodeterioration & Biodegradation, v. 139, p. 78–85, 2019b. Disponível em: <https://www.sciencedirect.com/science/article/pii/S0964830518307637>.
JIANG, W. et al. A critical review of analytical methods for comprehensive characterization of produced water. Water, v. 13, n. 2, p. 183, 2021.
JIMÉNEZ, S. et al. State of the art of produced water treatmentChemosphere, 2018. .
JOHNSON, R. J. Combining Advanced Biocide Evaluation and Microbial Monitoring to Optimise Microbial Control. In: SPE International Conference on Oilfield Chemistry, Anais…OnePetro, 2017.
KAHRILAS, G. A. et al. Biocides in Hydraulic Fracturing Fluids: A Critical Review of Their Usage, Mobility, Degradation, and Toxicity. Environmental Science & Technology, v. 49, n. 1, p. 16–32, 6 jan. 2015. Disponível em: <https://doi.org/10.1021/es503724k>.
KARATZAS, K. A. G. et al. Phenotypic and proteomic characterization of multiply antibiotic-resistant variants of Salmonella enterica serovar Typhimurium selected following exposure to disinfectants. Applied and environmental microbiology, v. 74, n. 5, p. 1508–1516, 2008.
KEASLER, V. et al. Expanding the microbial monitoring toolkit: Evaluation of traditional and molecular monitoring methods. International Biodeterioration & Biodegradation, v. 81, p. 51–56, 2013.
KEASLER, V. et al. Biocides overview and applications in petroleum microbiology. Trends in oil and gas corrosion research and technologies, p. 539–562, 2017.
LAHME, S. et al. Metabolites of an oil field sulfide-oxidizing, nitrate-reducing Sulfurimonas sp. cause severe corrosion. Applied and environmental microbiology, v. 85, n. 3, p. e01891-18, 2019.
LEE, M. H. P. et al. Effects of biocides on gene expression in the sulfate-reducing bacterium Desulfovibrio vulgaris Hildenborough. Applied Microbiology and Biotechnology, 2010.
LI, X.-X. et al. Microbiota and their affiliation with physiochemical characteristics of different subsurface petroleum reservoirs. International Biodeterioration & Biodegradation, v. 120, p. 170–185, 2017.
LI, Y. et al. Enhanced biocide mitigation of field biofilm consortia by a mixture of D-amino acids. Frontiers in microbiology, v. 7, p. 896, 2016.
LOIKO, N. et al. Biocides with Controlled Degradation for Environmentally Friendly and Cost-Effective Fecal Sludge Management. Biology, v. 12, n. 1, p. 45, 2022.
LU, H. et al. FeS Scale Control and Prevention in Water Injection Systems. In: SPE International Oilfield Scale Conference and Exhibition, Anais…OnePetro, 2022.
MAILLARD, J.-Y. Resistance of bacteria to biocides. Microbiology spectrum, v. 6, n. 2, p. 2–6, 2018.
MARCIALES, A. et al. Mechanistic microbiologically influenced corrosion modeling—A reviewCorrosion Science, 2019. .
MERCHEL PIOVESAN PEREIRA, B. et al. Tolerance to Glutaraldehyde in Escherichia coli Mediated by Overexpression of the Aldehyde Reductase YqhD by YqhC Frontiers in Microbiology , 2021. . Disponível em: <https://www.frontiersin.org/article/10.3389/fmicb.2021.680553>.
MIGNEAULT, I. et al. Glutaraldehyde: behavior in aqueous solution, reaction with proteins, and application to enzyme crosslinking. Biotechniques, v. 37, n. 5, p. 790–802, 2004.
MOISEEV, D. V; JAMES, B. R. Tetrakis (hydroxymethyl) phosphonium salts: Their properties, hazards and toxicities. Phosphorus, Sulfur, and Silicon and the Related Elements, v. 195, n. 4, p. 263–279, 2020.
MORENTE, E. O. et al. Biocide tolerance in bacteria. International journal of food microbiology, v. 162, n. 1, p. 13–25, 2013.
MUYZER, G.; STAMS, A. J. M. The ecology and biotechnology of sulphate-reducing bacteriaNature Reviews Microbiology, 2008. .
NASSER, B. et al. Characterization of microbiologically influenced corrosion by comprehensive metagenomic analysis of an inland oil field. Gene, v. 774, p. 145425, 2021.
OBŁĄK, E.; FUTOMA-KOŁOCH, B.; WIECZYŃSKA, A. Biological activity of quaternary ammonium salts and resistance of microorganisms to these compounds. World Journal of Microbiology and Biotechnology, v. 37, n. 2, p. 22, 2021. Disponível em: <https://doi.org/10.1007/s11274-020-02978-0>.
PAIJENS, C. et al. Determination of 18 biocides in both the dissolved and particulate fractions of urban and surface waters by HPLC-MS/MS. Water, Air, & Soil Pollution, v. 231, n. 5, p. 210, 2020.
PASCHOALINO, M. et al. Evaluation of a glutaraldehyde/THNM combination for microbial control in four conventional oilfields. In: SPE International Conference on Oilfield Chemistry, Anais…OnePetro, 2019.
PASCHOALINO, M. Influence of Chemical Treatments and Topside Processes on the Dominant Microbial Communities at Conventional Oilfields. In: Microbial Bioinformatics in the Oil and Gas Industry. [s.l.] CRC Press, 2021. p. 81–97.
PEREIRA, G. F.; PILZ-JUNIOR, H. L.; CORÇÃO, G. The impact of bacterial diversity on resistance to biocides in oilfields. Scientific reports, v. 11, n. 1, p. 1–12, 2021.
RAJBONGSHI, A.; GOGOI, S. B. A review on anaerobic microorganisms isolated from oil reservoirs. World Journal of Microbiology and Biotechnology, v. 37, n. 7, p. 1–19, 2021.
ROMERO, J. M. et al. Genetic Monitoring of Bacterial Populations in a Sea Water Injection System, Identification of Biocide Resistant Bacteria and Study of their Corrosive Effect. In: CORROSION 2005, Anais…OnePetro, 2005.
SAUER, K. et al. Neutral super-oxidised solutions are effective in killing P. aeruginosa biofilms. Biofouling, v. 25, n. 1, p. 45–54, 2009.
SIERRA-GARCIA, I. N. et al. Microbial diversity in degraded and non-degraded petroleum samples and comparison across oil reservoirs at local and global scales. Extremophiles, v. 21, n. 1, p. 211–229, 2017.
SKOVHUS, T. L.; WHITBY, C. Oilfield Microbiology. [s.l.] CRC Press, 2019.
STEPANOVIĆ, S. et al. Quantification of biofilm in microtiter plates: overview of testing conditions and practical recommendations for assessment of biofilm production by staphylococci. Apmis, v. 115, n. 8, p. 891–899, 2007.
TABATA, A. et al. Correlation between resistance of Pseudomonas aeruginosa to quaternary ammonium compounds and expression of outer membrane protein OprR. Antimicrobial agents and chemotherapy, v. 47, n. 7, p. 2093–2099, 2003.
UNSAL, T. et al. Assessment of 2, 2-Dibromo-3-Nitrilopropionamide Biocide Enhanced by D-Tyrosine against Zinc Corrosion by a Sulfate Reducing Bacterium. Industrial & Engineering Chemistry Research, v. 60, n. 10, p. 4009–4018, 2021.
VIKRAM, A.; BOMBERGER, J. M.; BIBBY, K. J. Efflux as a glutaraldehyde resistance mechanism in Pseudomonas fluorescens and Pseudomonas aeruginosa biofilms. Antimicrobial Agents and Chemotherapy, 2015.
WADE, S. A. et al. The role of standards in biofilm research and industry innovation. International Biodeterioration & Biodegradation, v. 177, p. 105532, 2023. Disponível em: <https://www.sciencedirect.com/science/article/pii/S0964830522001603>.
WANG, D. et al. Mitigation of carbon steel biocorrosion using a green biocide enhanced by a nature-mimicking anti-biofilm peptide in a flow loop. Bioresources and Bioprocessing, v. 9, n. 1, p. 67, 2022. Disponível em: <https://doi.org/10.1186/s40643-022-00553-z>.
WILLIAMS, T. M.; MCGINLEY, H. R. Deactivation of industrial water treatment biocides. In: CORROSION 2010, Anais…OnePetro, 2010.
XU, D. et al. D-amino acids for the enhancement of a binary biocide cocktail consisting of THPS and EDDS against an SRB biofilm. World Journal of Microbiology and Biotechnology, v. 28, n. 4, p. 1641–1646, 2012.
XU, D.; LI, Y.; GU, T. Mechanistic modeling of biocorrosion caused by biofilms of sulfate reducing bacteria and acid producing bacteria. Bioelectrochemistry, 2016.
XU, L. et al. Inadequate dosing of THPS treatment increases microbially influenced corrosion of pipeline steel by inducing biofilm growth of Desulfovibrio hontreensis SY-21. Bioelectrochemistry, p. 108048, 2022. Disponível em: <https://www.sciencedirect.com/science/article/pii/S156753942100311X>.
YULI, I.; TZAFRIR, I.; SALAMA, P. Compatibility Investigation of Cationic Surfactants with Anionic Species. Cosmetics, v. 10, n. 2, p. 45, 2023.
___________________________________________________

___________________________________________________